密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





引言

《胃肠病学》(Gastroenterology)是美国胃肠病学会(American Gastroenterology Association,AGA)的官方杂志,是国际消化病学领域的顶级学术期刊,提供了胃肠病学基础和临床研究的最新和权威报道。首都医科大学附属北京友谊医院是国家消化系统疾病临床医学研究中心和消化健康全国重点实验室依托单位,是AGA在中国唯一官方指定授权发布《胃肠病学》杂志翻译的单位。
本期为大家带来《古塞奇尤单抗治疗中度至重度活动性溃疡性结肠炎患者:QUASAR 2b期诱导治疗研究》,敬请关注!


<第10期>

古塞奇尤单抗治疗中度至重度活动性溃疡性结肠炎患者:QUASAR 2b期诱导治疗研究

背景与目的
QUASAR 2b期诱导治疗研究评估了白介素-23p19亚基拮抗剂古塞奇尤单抗(Guselkumab)在糖皮质激素、免疫抑制剂和(或)生物制剂等高级药物治疗应答不足和/或不耐受的中度至重度活动性溃疡性结肠炎(UC)患者中的疗效及安全性。

方法
在这项双盲、安慰剂对照、剂量探索、诱导缓解治疗研究中,患者被随机分组(1:1:1),分别在第0/4/8周接受静脉注射200 mg或400 mg古塞奇尤单抗或安慰剂。主要观察终点为治疗12周时的临床应答(与基线相比,改良Mayo评分降低≥30%且降低≥2分,直肠出血子项评分下降≥1分或该子项评分为0/1)。古塞奇尤单抗治疗组和安慰剂组在第12周临床无应答者在12/16/20周(非对照研究期)接受皮下或静脉注射古塞奇尤单抗 200 mg治疗。

结果
主要分析人群纳入了基线的改良Mayo评分≥5分和≤9分的患者(古塞奇尤单抗200 mg静脉注射组n=101;古塞奇尤单抗400 mg静脉注射组n=107;安慰剂组n=105)。在第12周,古塞奇尤单抗200 mg组(61.4%)和400 mg组(60.7%)的临床应答率高于安慰剂组(27.6%,p值均<0.001)。在第12周,与安慰剂组相比,古塞奇尤单抗组达到所有次要观察终点(临床缓解、症状缓解、内镜下改善、内镜-组织学黏膜改善和内镜下黏膜正常化)的患者比例均更高。在古塞奇尤单抗治疗第12周临床无应答的患者中,200 mg组和400 mg组分别有54.3%和50.0%的患者在第24周达到了临床应答。古塞奇尤单抗治疗组和安慰剂组的安全性相似。
结论

在中度至重度活动性UC患者中,与安慰剂相比,古塞奇尤单抗静脉诱导治疗有效。古塞奇尤单抗是安全的,并且在不同治疗剂量组之间的有效性和安全性相似。
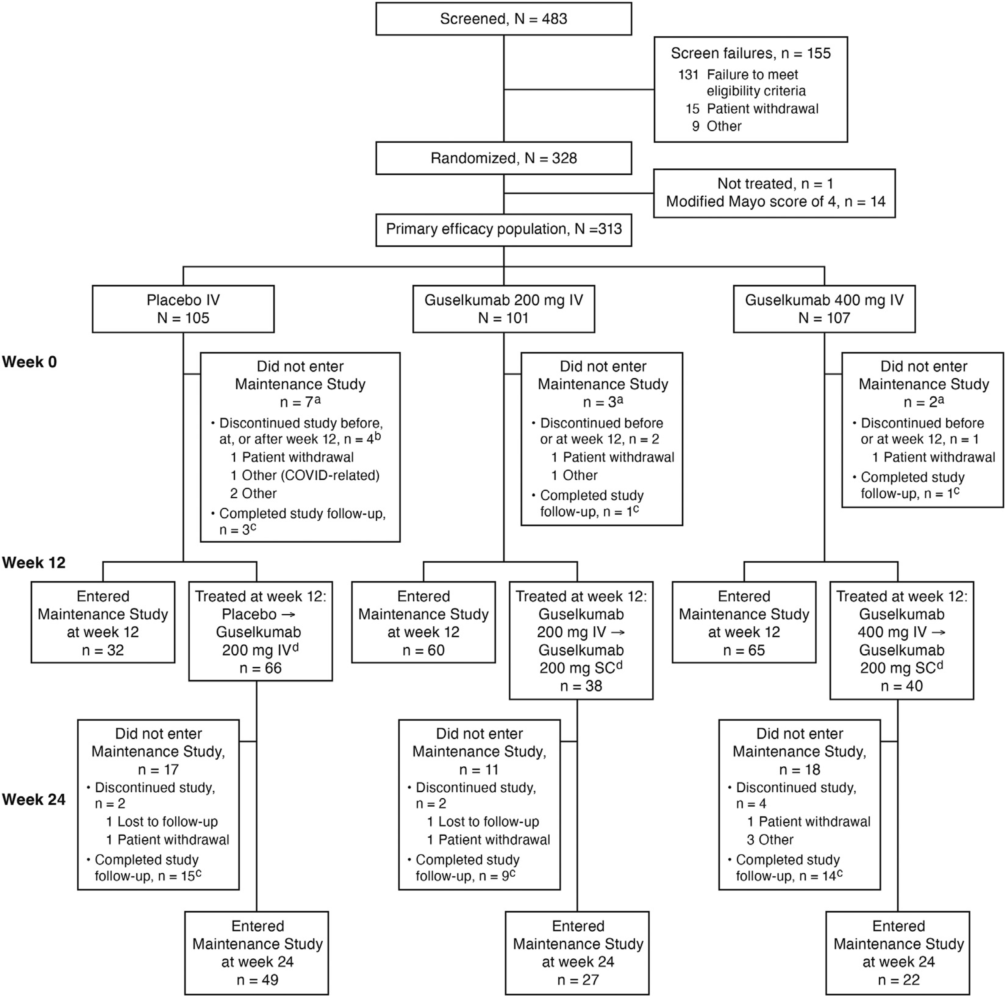
图1 研究流程图
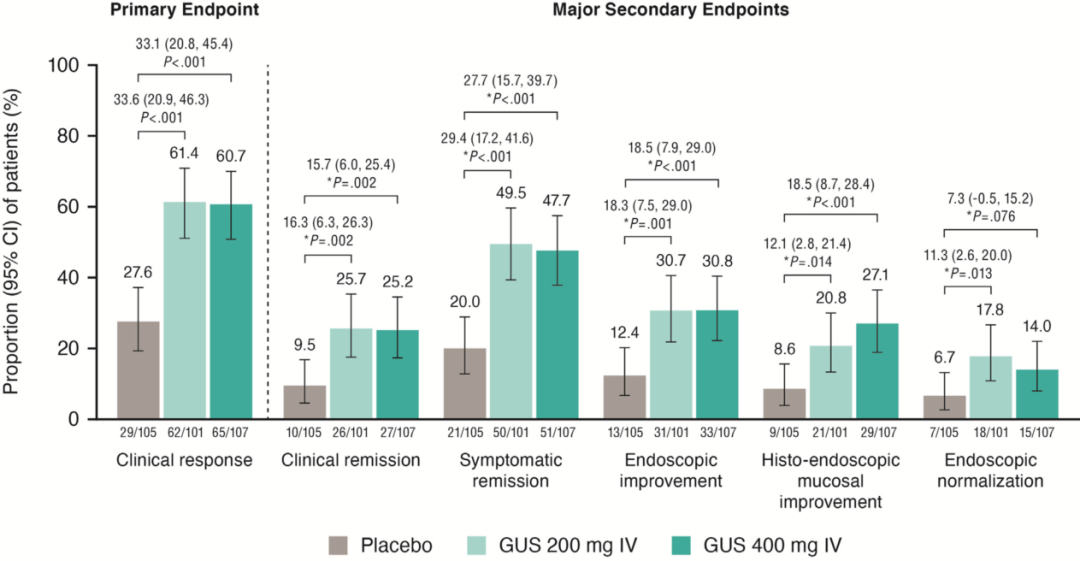
图2 在第12周各组的主要观察终点和次要观察终点

图3 0-12周症状应答率(A)、部分Mayo评分(粪便频率、直肠出血和医师总体评估得分之和)的变化(B)、排便频率子项得分为0或1分的患者比例(C)、直肠出血子项得分为0分的患者比例(D)
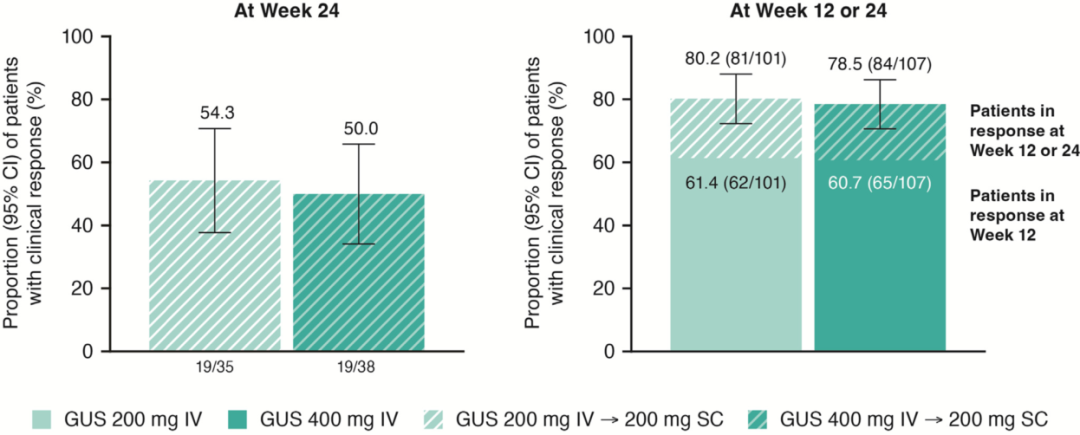
图4 左:古塞奇尤单抗12周治疗无应答患者在第24周时治疗应答率;右:接受古塞奇尤单抗治疗的患者在第12周或第24周时的累积应答率
研究者说
在中重度活动性UC患者中开展的这项研究表明,与安慰剂相比,古塞奇尤单抗静脉诱导治疗在第12周时获得了更高的临床缓解率。在第12周,与安慰剂相比,古塞奇尤单抗诱导治疗还提高了所有次要观察终点的达标率。并且,该研究纳入了对其他生物制剂治疗应答不足/不耐受的患者,结果提示,没有对生物制剂治疗应答不足/不耐受的患者比有此病史的患者有更高的临床应答率。接受古塞奇尤单抗治疗的患者在第2周(第一个评估时间点)就已经显示出明显的临床症状缓解,血清炎症标志物水平C反应蛋白(CRP)和粪便钙卫蛋白在第4周(第一个评估时间点)可观察到有统计学意义的降低。在第12周时,古塞奇尤单抗治疗组受试者在健康相关生活质量评分(Health-related quality of life, HRQoL)、患者报告的症状和疲劳方面的改善程度均明显超过安慰剂组。
本研究采用的两种剂量的古塞奇尤单抗治疗在第12周时的所有观察终点的疗效均相似,未观察到与剂量相关的临床结局差异。另外,在第12周对古塞奇尤单抗无应答的患者中,无论其接受静脉诱导治疗的剂量是200 mg还是400 mg,额外的12周古塞奇尤单抗皮下治疗临床获益相似。
在本研究中,对于第12周时对200 mg或400 mg古塞奇尤单抗静脉诱导治疗无应答的患者,额外的200 mg古塞奇尤单抗皮下给药治疗可使超过50%的患者达到临床应答。总体而言,大约80%的随机接受古塞奇尤单抗治疗的患者在第12周或第24周达到临床缓解,说明古塞奇尤单抗的疗效随着治疗时长的延长而增加。本研究中两种剂量的古塞奇尤单抗的耐受性良好,不良事件发生率和安慰剂组相似。
本研究纳入UC患者人群较为广泛,且较多为疾病负担较重的患者,包括使用过≥2种生物制剂治疗的难治性UC和内镜下评估为重度炎症的UC患者。对于此类中重度活动期UC患者,200 mg和400 mg的古塞奇尤单抗诱导治疗显示出较好的疗效。此外,对于古塞奇尤单抗静脉注射治疗12周无应答的患者,也可从额外的古塞奇尤单抗皮下给药治疗中获益。这些结果表明古塞奇尤单抗是一种有前景的UC治疗药物,也证实了IL-23特异性细胞内信号在炎症性肠病的发病机制中具有重要作用。古塞奇尤单抗治疗的适用范围、古塞奇尤单抗与TNF-α拮抗剂等生物制剂联合治疗的有效性和安全性等方面仍需要进一步的研究。
译者简介
译者
孟祥辰
医学博士
消化内科主治医师
医学博士,首都医科大学附属北京友谊医院消化内科主治医师。在国际、国内学术期刊发表论文10余篇。研究方向:肠道微生态和炎症性肠病、胆胰系统疾病诊疗。
审核
施海韵
医学博士、副主任医师
副教授、青年博导
首都医科大学附属北京友谊医院消化内科副主任医师,副教授,青年博导。北京医学会消化病学分会肠道疾病专业副召集人,北京医学会消化病学分会青年论坛副召集人。入选北京市优秀青年人才、北京市科技新星计划等多项人才计划。主持国家自然科学基金、首都临床特色应用研究等多项科研课题。在国际、国内学术期刊发表论文30余篇,多次在DDW、APDW等国际国内学术会议做汇报交流并获青年研究者奖。主要研究方向:炎症性肠病、结直肠肿瘤与肠道微生态。
总审核
张澍田
主任医师、教授
博士生导师
首都医科大学附属北京友谊医院院长,消化健康全国重点实验室主任,国家消化系统疾病临床医学研究中心主任,国家临床医学协同研究创新联盟秘书长,中国医院协会第三、四届副会长,中华医学会消化内镜学分会第七届主任委员,中华医学会消化病学分会第九届副主任委员,北京医学会消化内镜学分会第六届主任委员,北京医学会消化病学分会第十届主任委员,中国医师协会消化医师分会第四、五届会长,亚太消化内镜学会第六、七届委员,世界华人消化医师协会第一届会长,中华消化内镜杂志主编,中华消化杂志副主编,中华医学杂志(英文版)副主编。
首都医科大学附属北京友谊医院
消化中心简介


首都医科大学附属北京友谊医院消化中心以食管、胃肠及肝胆胰腺疾病的内镜介入(微微创)诊断与治疗为特色,国内领先、国际知名。是消化健康全国重点实验室、国家消化系统疾病临床医学研究中心、国家重点临床专科、北京市消化疾病中心,是首都医科大学消化健康学院挂靠单位。由消化一、二、三科、消化内镜中心(全球20家最卓越之一)和消化实验室组成,共有医生88人、科研人员12人、科研辅助人员15人、护士94人。西城院区位于首都核心区(前门南、天坛西),通州院区位于北京城市副中心,顺义院区位于首都机场附近的后沙峪。
(本文版权属于中国医学论坛报社,转载须授权)