密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:上海交通大学附属第六人民医院 陈明云 李连喜
系列文章推荐
晚期糖基化终产物(AGEs)是还原糖的醛基与蛋白质、脂质或核酸之间,由非酶促反应形成的一组修饰分子产物。AGEs除了形成于高血糖外,还可产生于糖的自氧化、氧化应激及炎症反应中。细胞内和细胞外蛋白通过糖的修饰作用生成AGEs,此过程是不可逆的,AGEs逐渐积累并最终导致蛋白质的功能丧失。
AGEs的形成和聚集与衰老进程及加速糖尿病大血管病变进程密切相关,持续的高血糖可促使蛋白质与葡萄糖发生非酶催化的糖基化反应,最终形成 AGEs,人体内AGEs水平与血糖浓度的高低密切相关,糖尿病患者体内存在着高水平的AGEs。
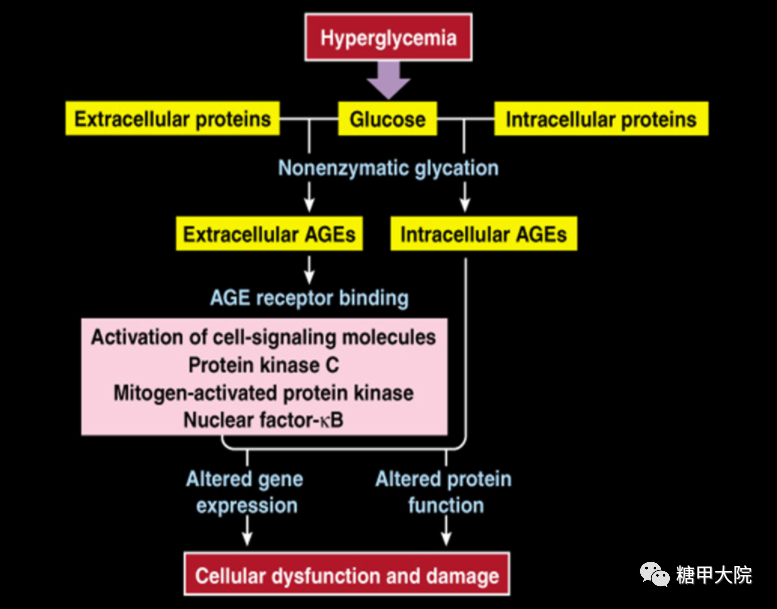
晚期糖基化终产物(AGEs)途径
AGEs形成主要有下列三种生化机制:糖化途径、多元醇途径、糖氧化途径。
糖化途径
糖化是一种非酶促反应,葡萄糖的醛基与蛋白质赖氨酸残基上的ε-氨基缩合生成西佛碱(schiff base),西佛碱经重排形成相对稳定而不可逆的酮胺化合物,即阿马多里(amadori)产物。阿马多里产物进一步分子修饰,逐渐经脱水、环化、氧化和重排形成AGEs。在常规临床检验中最为人熟悉的糖基化中间产物是糖化血红蛋白。在阿马多里产物重组期间,反应性中间体羰基积累。这些化合物被称为二羰基或氧代醛,包括3-脱氧葡萄糖醛酮和甲基乙二醛的产物等。α-二羰基具有与蛋白质中的氨基、巯基和胍官能团反应的能力,导致靶蛋白质的变性,褐变和交联。
多元醇途径
葡萄糖经过多元醇途径生成AGEs实际上是一个酶依赖性的反应。葡萄糖通过醛糖还原酶或山梨醇脱氢酶转化成中间产物,在与蛋白质结合后成为AGEs。如上所述,果糖作为一种活性酶,可促进AGEs的生成。
糖氧化途径
糖氧化途径通常发生在线粒体中超氧化物生成增加的条件下或依赖于氧化还原敏感机制,后者产生羟基自由基并导致形成乙二醛和甲基乙二醛。这些高反应性二羰基代谢物是非常不稳定的,可以与不同的生物分子快速反应形成AGEs。
如上所述,我们可以推断AGEs并不是单一成分,而是由一组异质的分子构成,其中多种成分已获得广泛研究。AGEs能引发炎症和促凝反应,导致组织损伤,并且这些反应通常靶向特定器官。AGEs在糖尿病周围大血管病变中的致病作用已经被诸多研究所证明,例如,AS斑块中就存在AGEs。AGEs促进糖尿病周围大血管损伤的发生,加速动脉粥样硬化进程主要通过受体或非受体途径。
非受体途径
AGEs直接改变血管壁细胞外基质分子的功能特性。被AGEs所修饰的蛋白在结构上发生改变,进而影响到蛋白质的功能,因此与糖尿病大血管病变相关的某些蛋白被AGEs修饰后其性质发生变化、功能受到损害,进而导致糖尿病AS病变的发生。例如,AGEs沉积在局部组织,可直接与血管基底膜蛋白发生交联,导致血管僵硬,被其他大分子所捕获。此外,被AGEs修饰的脂蛋白的致AS作用明显增强,研究发现,LDL脂蛋白颗粒经AGEs修饰后可能改变LDL受体所介导的脂质清除,从而导致血脂紊乱,进而促进糖尿病大血管病变的发病。
受体途径
AGE受体 (receptor for AGE,RAGE)是目前研究最为深入的受体之一。血管内皮细胞、血管平滑肌细胞以及巨噬细胞上都存在RAGE。AGEs可能通过与血管内皮细胞、血管平滑肌细胞以及巨噬细胞上的RAGE发生相互作用从而在糖尿病大血管病变的发生、发展中起重要作用。RAGE是一个跨膜信号受体,可改变细胞功能、促进基因表达、增强促炎细胞因子的释放。AGE–RAGE的相互作用可以引发信号转导级联反应而导致细胞内活性氧的产出,而活性氧可以触发炎症反应,因此血管细胞上AGE-RAGE的相互作用可以引发血管的炎症反应,进而导致血管损伤的发生。然而,RAGE不仅与AGEs相互作用,还与多种配体发生相互作用,包括S100B/钙调素、炎性配基等,从而促进AS进程。在动脉粥样硬化病变过程中,RAGE这种多配体的受体在血管内皮细胞、血管平滑肌细胞和炎性细胞中高度表达,并且通过与其配体的相互作用进而参与诱导并维持动脉粥样硬化病变的病理过程。
目前已经有大量研究通过转基因小鼠模型,使用RAGE的抑制剂或RAGE的遗传缺失或修饰等方法证明了RAGE表达水平或功能的改变能影响AS过程,从而证实了AGE-RAGE的相互作用在AS发病中发挥重要作用。如Forbes等人研究发现,给ApoE基因敲除小鼠进食氨基胍(抑制AGEs形成)或ALT-711(抑制AGE交联反应)后,小鼠主动脉组织和血浆中AGEs的表达水平显著降低,血管斑块的面积明显减少,分别减少40%和30%,而主动脉中的胶原特别是I型、Ⅲ型和IV型胶原以及某些介导增值作用的细胞因子如TGF-β、结缔组织生长因子等含量也随之减少。而Park等人则通过给ApoE基因敲除的糖尿病小鼠喂食可溶性的RAGE(sRAGE)也进一步证实了AGEs在AS中的致病作用。sRAGE可以结合AGEs,从而减少体内AGEs的含量,研究发现,喂食sRAGE的糖尿病小鼠相较于对照组小鼠的AS斑块面积明显减少,而且这种抑制作用是独立于血糖和血脂的。
然而,AGEs在AS发病中的作用目前还存在某些争议,这也从另一方面说明了糖尿病AS发病的复杂性,提示了多种因素参加糖尿病AS的病变,AGEs仅仅是其中的一个因素,而且这些因素之间还可能存在着十分复杂的相互作用关系,有待进一步研究。
来源:糖甲大院