查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过





作者:安徽医科大学第一附属医院 吴兴启 周珊珊 汪凯
阿尔茨海默病(Alzheimer’s Disease,AD)是多发于老年人的神经系统变性疾病,临床上以进行性记忆、认知障碍及行为异常为特征,典型的病理学表现为淀粉样蛋白沉积、神经原纤维缠结(NFT)、神经元减少及轴索和突触异常、颗粒空泡变性等。但对其发病原因和具体机制仍知之甚少,且缺乏有效的治疗方法。2018年美国国立衰老研究院和阿尔茨海默病协会(National Institute of Aging and Alzheimer’s Association,NIA-AA)提出了AD的生物学定义,即基于Aβ蛋白(A)、病理性Tau蛋白(T)及神经变性(N)生物标记物的ATN(Aβ-Tau-Neurodegeneration,ATN)诊断标准,是近来利用AD生物标志物的组合指导AD临床早期干预标准化的重要突破。本文拟对AD临床亚型研究,ATN诊断标准的特点及相关标志物,与神经心理学的关联及治疗进展进行综述。
阿尔茨海默病的历史:迷茫中的探索
1907年,德国的Alois Alzheimer医生首次发现并报道了AD。随后百年展开大量的研究和探索,并经历了由病理、临床到生物学水平的不同阶段。但至今仍未揭示AD的发病机制且无有效的治疗药物。尽管现有研究表明,Aβ、Tau蛋白异常沉积可能是AD的病理生理机制,但仍存在诸多困惑。尽管有着相同的病理改变,但临床表征却存在不同,而对机制认识的不清,也进一步使得药物的研发陷入困境。
针对AD临床表现及病理的研究发现AD是一种异质性的疾病,发病年龄和临床表现具有显著的异质性。根据发病年龄,临床可以将AD分为早发型AD(<65岁)和晚发型AD(≥65岁),二者在临床表现及转归上有着较大的差异。早发型AD常常表现为语言障碍、视空间障碍等非遗忘症状且病程进展较快;晚发型AD则多表现为记忆障碍,病情进展相对缓慢。二者之间同样具有不同的病理形态改变,早发型AD常表现为更为严重的病理改变及脑萎缩。根据不同的临床表现,AD常分为典型AD,后皮质萎缩变异型AD(posterior cortical atrophy,PCA),Logopenic失语变异型AD(LvPPA)和额叶变异型AD(frontal varies AD,fAD)等4种临床表型,其中PCA、LvPPA和fAD又被称为非典型AD。研究表明,在45-65岁的人群中,AD的发病率约为万分之3~7;其中非典型AD约占三分之一。非典型AD较典型AD的疾病进展速度快、病情更加严重,对家庭和社会产生的影响更加严重,但临床研究较为匮乏。基于病理水平的研究发现,尽管不同临床表型的AD均具有老年斑及NFT等AD的典型病理改变,但其累及的脑区及脑萎缩的模式不同,提示未来应当探索不同亚型AD具体的病理机制,即病理改变空间分布异质性的潜在原因。
针对15万AD患者的大型研究发现,载脂蛋白E4(apolipoprotein E,ApoE)是AD的主要遗传危险因素。单个APOE4等位基因的携带者,终生罹患AD的风险为20%~30%,是非携带者的3.2倍,同时携带2个APOE4等位基因的人群,终生罹患AD的风险为50%,是非携带者的8-12倍。APOE4的代谢产物能与Aβ的清除和神经毒性片段的产生有关。基于小鼠模型的研究发现,APOE4与脑血管变性、血脑屏障破坏有关,而这些均与AD的发病密切相关。现有的证据表明非典型AD患者中APOE4的携带者比例较典型AD患者少,其原因可能是现有非典型AD的研究较少。这些研究均表明APOE4的多形性与散发性AD间复杂的相互作用机制。此外,APP基因、PS-1基因、PS-2基因和TREM2等均是AD的风险基因,增加了AD 50%~60%的患病风险。除风险基因外,同样发现诸多保护性基因。如,APOE2可以降低一半的AD发病风险。APP基因的la673Thr突变型与高寿人群的高认知水平密切相关,同样可以降低老年人群AD的发病风险。探索此类保护性基因变异降低AD发病风险的潜在机制为探索预防AD发病、保护认知健康的方法提供了新视角。
不同表型的AD具有不同的神经心理学特征:①PCA的核心特征是视空间觉障碍,视觉参与的评估受损,而情景记忆功能相对保留;②LvPPA主要表现为进行性地找词困难、复述困难,但理解功能和语法正常。而记忆、执行、视空间功能相对保留;③fAD的表现包括工作记忆、认知灵活性下降和淡漠等非脱抑制症状。虽然,非典型AD常常因为其不典型的临床症状及缺少内侧颞叶及海马萎缩的证据而被误诊或延迟诊断。神经心理学评估能够客观的量化认知功能,可以刻画个体的认知功能特征,能够辅助早期识别非典型AD。因此,神经心理学评估为早期识别AD,提供了有效工具。需要注意的是,在疾病后期不同表型的AD的神经心理学特征消失,均表现为全面的认知功能障碍。故而在实际操作中,对晚期AD神经心理学评估的结果应在整体认知评估的背景下进行个体化的解释。
对AD病理机制的认识,限制了AD治疗药物及策略的探索。目前为止,仅有5种药物批准用于AD治疗,均只能改善症状,而对其病理毫无影响。现有的治疗药物对非典型AD的症状并无改善效应。近些年,尽管有大量的药物试验展开,用以探索改善AD患者认知功能、神经精神和行为症状、缓解病情进展,但均以失败告终。其中包括靶向减少Aβ和tau蛋白产生和沉积的单克隆抗体药物。其主要原因包括AD病理的异质性、药物实验对象选择的异质性、干预时机延迟和缺少有效的终点指标等几个方面。
阿尔茨海默病的生物学定义:停滞中的前行
1. 阿尔茨海默病的生物学定义
Aβ和Tau蛋白沉积,是AD的典型病理改变。既往对于AD的确诊依赖于尸检病理证实Aβ沉积和tau聚集造成的脑组织损伤。近年来,生物标志物研究的进展使得可以通过脑脊液、影像及血清等多种途径检测AD的特征性病理改变,有利于从病理学层面揭示AD的发病机制。在此基础上,NIA-AA在生物学水平上定义了AD,将具有相同生物标记的不同阶段及表型的AD疾病谱纳入同一个研究框架即A-T-N框架,为探索AD的生物学异质性提供了依据。在A-T-N框架中,A代表Aβ累积及相关病理状态,T代表Tau蛋白累积(神经纤维缠结)及相关病理状态,N代表神经受损的程度。在ATN框架中,AD被定义为生物学水平的疾病谱系,包括AD病理改变和AD。其中,仅具有Aβ沉积生物标志物证据,但病理性Tau标志物正常的人[A(+)T(-)(N)]称为“AD病理改变”。Aβ和病理性tau标志物均阳性[A+T+(N)]时方可定义为AD。且这些定义与其症状无关,如早发/晚发;症状前期/症状期;临床表现典型/不典型等,见图1。在ATN框架中把神经变性/神经元损伤标志物和认知障碍定义为AD的非特异性改变,仅用于严重程度分期,而不用于确定是否属于AD疾病谱。
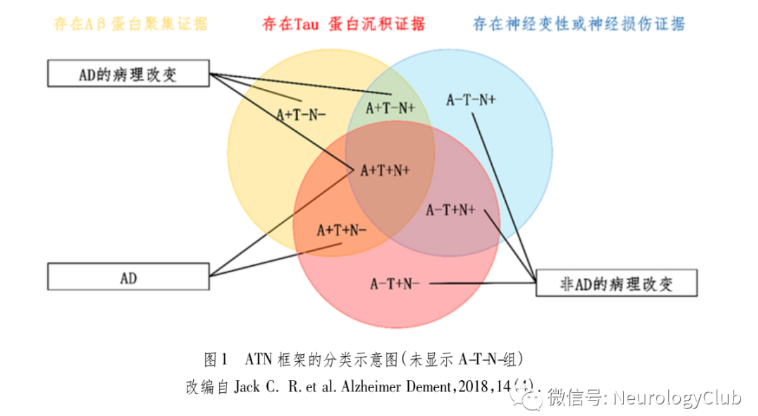
在生物学定义的基础上,来自神经心理学评估的认知表现则可以区分患者临床变化的严重程度,将其分为认知未损害、轻度认知损害和痴呆3个阶段,即形成了A-T-N(C)系统。临床表现提供了具体的表征,生物标记提供了分子水平的病理证据,二者互补,使得可以深入探索AD的生物机制,并能够直观发现AD病理改变所造成的影响。生物标记物和传统神经心理学的结合能够极大地改变现有AD的诊疗,使得早期AD诊断成为可能。Aβ、Tau及神经损伤的证据可以来自体液或是影像学检查。
2. 体液标志物
脑脊液中的Aβ42(反映大脑皮层中的淀粉样沉积)、总Tau(T-tau,反映神经退行性变的程度)和磷酸化tau蛋白(p-tau,反映神经纤维纤维病变程度)是AD较为准确的生物标志物,目前较为常用的方法是酶联免疫吸附法,其敏感性和特异性高达85%-90%,能够准确地识别AD所致的轻度认知障碍。然而,现有的生物标志物在健康老年人群中同样存在,且缺少有效的截断值。其主要原因是不同实验室之间测量方法的差异。标准化的测量流程能够有效降低不同实验室测量的异质性,因此,应当建立标准化的测量方案,探索可靠的临床截断值。此外,在AD中同时存在的α-突触核蛋白、TDP43和血管因素严重影响了现有生物标志物的敏感性和特异性。故而,在提高Aβ42、T-tau和p-tau诊断效能的同时,应当探索新型的生物标志物。新近研究发现,能够反映轴突损伤和突触功能障碍的神经颗粒素、突触凝集素在AD患者中显著增加,且与其认知功能相关,具有成为新型标志物的潜力。脑脊液生物标志物的应用对临床诊疗策略的制定及提高大型临床试验受试者一致性具有重要价值。
超灵敏检测技术使通过血清检测AD的生物标志物成为可能。相比于脑脊液,血液生物标志物更容易获得和接受,可以在人群中推广和筛查。因此,积极探索AD的血清学标志物具有重要意义。神经丝轻链(neurofilament light)是一种主要的轴突细胞骨架蛋白,其在血液中的水平与脑脊液中的水平相似,因此可以作为神经变性的生物标志物。此外,神经丝轻链能够较好地鉴别额颞叶痴呆,进一步提示它在痴呆等疾病诊疗中的作用。新型的检测技术(免疫沉淀质谱法、微流控技术等)能够准确探测到血浆中Aβ浓度的降低,为利用血液指标对AD进行筛查、诊断和治疗效果的评估带来了希望。但目前的检测技术仍有待优化。同样的,通过血液标本能够准确测量p-tau,并可作为AD与其他痴呆的诊断生物标志物。基于血液的检测技术的迅速发展,AD血液生物标志物被大量开发,使得在人群中展开早期筛查成为可能。
3. 影像标志物
目前,较为认可的AD神经影像标志物包括MRI(海马体积)、18FDG-PET及Aβ-PET成像。需要注意的是,其在临床应用的效应仍需进一步的验证。18FDG-PET是临床中应用最广的PET功能成像检查,可准确评估神经元和胶质细胞的葡萄糖摄取量,对神经退行性疾病的鉴别诊断、短期临床结果的预测及神经退行变的程度和定位有重要价值。具有较高的灵敏度,结果的解读依赖于整体皮层代谢模式的改变而非单个脑区,例如后扣带回和颞顶叶代谢减退提示AD,而对称/不对称的前额叶低代谢则提示额颞叶痴呆。现有的18FDG-PET结果解读仍依赖于医师个体,存在较大的主观性。因此,未来应探索18FDG-PET的标准化流程、开发模式识别软件提高不同中心间检查的可重复性,以便于18FDG-PET在个体水平中的应用。Aβ-PET能够反映大脑中Aβ的负荷,其具有较高的阴性预测效应,即Aβ-PET阴性的患者不太可能患有AD。其在临床中的应用主要体现在提高早发型AD的准确率及AD的早期诊断。需要注意的是,现有的Aβ-PET检查特异性相对较低,60岁以上认知健康的人中,Aβ-PET的阳性率高达35%。此外,一项大型荟萃分析提示,大脑皮层的Aβ-PET与年龄密切相关。因此,对Aβ-PET结果的解释应当进一步优化,比如仅以部分特异性脑区(而非全脑)Aβ-PET的阳性作为AD的生物标志物,具有提高Aβ-PET检测灵敏度的可能。未来还应探索更优化的显影剂,以更好地与病理性Aβ结合,提高Aβ-PET对AD的特异度。
Tau-PET是近些年被开发应用的影像标志物,其能够反映脑内的tau蛋白分布及负荷程度,与AD的临床表现和Braak病理分期有较好的一致性。此外,相较于Aβ-PET,Tau-PET与大脑皮层的低代谢和萎缩程度具有更好的相关性,且在不同AD的临床表型中有着特异性的表现。现有的Tau标志物有着较高的脱靶率,对Tau蛋白的选择性较低,因此,未来的PET显影剂应当着重增加选择性和信噪比,降低脱靶率,提高Tau-PET检查对AD的灵敏度与特异度。
多种神经影像方法的结合,及其与体液标志物的组合应用,可以显著提高对早期AD诊断的灵敏度及特异度,并能够准确预测未来认知功能的减退及病情转归。多种检查方式的联合使用将会增加患者负担。因此,未来应当优化不同标记物检查的组合和顺序,建立标准化的操作规范及参考指标,并进一步开发Aβ-Tau-PET、PET-MRI等新型的成像技术。
阿尔茨海默病的展望:希望与困惑
1. ATN框架下神经心理学的作用
神经心理学在AD的研究中有着不可替代的作用,包括定义痴呆、不同类型痴呆的鉴别、AD病情严重程度的判断和药物效果的检测等。ATN框架试图通过一系列生物标记物在生物学水平对AD进行定义,这给神经心理学在AD诊断中的作用带来了严峻的挑战。例如,在ATN框架下,哪些神经心理学评估能准确、灵敏地反映出AD的病理改变,哪些评估能够作为药物疗效的指标以及哪些神经心理学测试够预测其病情转归等。这些问题均亟待解决。
神经心理学评估与ATN框架的结合,有利于对AD异质性的理解。新近的观点认为,AD的异质性分为典型性和严重程度两个维度。基于生物标记物及神经影像学的A-T-N生物诊断框架能够提供AD的典型性证据,而神经心理学评估能够客观的量化认知功能,刻画个体的认知功能特征,提供AD的严重程度证据及表型特征。因此,二者的结合能够为我们在病理水平下揭示AD的发病机制的异质性及探索不同表型AD的精准干预策略提供了新思路。Ten Kate等研究发现,ADNI队列中AD患者的神经心理学特征具有较大的异质性,且其具有不同的皮层萎缩模式。另一项发表在Alzheimer’s Dementia上的一篇基于脑萎缩的纵向研究表明,利用磁共振成像和机器学习技术,能够通过健康老年人群的不同脑萎缩模式,准确预测其是否转化为AD及其亚型。这些结果证明了神经心理学评估和神经影像学生物标志物相结合在探索AD异质性中的潜能。因此,未来应当在ATN生物框架下,结合传统的神经心理学评估,探索不同亚型AD的病理生理机制,并在此基础上探索AD的早期诊断标记,开发有效的预防和精准干预方法。
2. 预防为主,综合干预
早期预防是一个降低AD发病的有效途径。有研究表明,通过对饮食、血糖、吸烟、饮酒、体重、高血压、糖尿病及抑郁等高危因素的干预能够降低约40%的AD发生。来自芬兰的FINGER研究表明,通过对饮食、体育锻炼、认知训练及社会活动的综合干预能够显著降低AD高危人群的患病风险。但是,单一的干预措施的预防效果并不理想。例如,在法国的MAPT试验和荷兰PreDIVA试验中分别通过补充ω-3脂肪酸和血管高危因素的干预并未能降低AD的患病风险。而生活方式和补充ω-3脂肪酸的联合干预则能够有效降低AD的发病风险。以上结果强调综合方式的干预对于预防AD发病的可行性。但是,既往研究未能揭示对AD的病理改变的影响。因此,未来应当结合体液及影像的生物标志物,探索其潜在的病理生理机制;并进一步明确各种生物标志物的作用及其与AD发病的关系。
3. 补偿治疗方法的探索
目前为止,AD仍缺少有效的药物治疗方法。因此,寻找AD的替代/补偿治疗方法成为热点。认知训练(cognitive training,CT)、经颅磁刺激(transcranial magnetic stimulation,TMS)和经颅电刺激(transcranial electrostimulation stimulation,TES)近年来广受关注。
CT能够提高脑功能的可塑性,进而改善健康老年、轻度认知障碍(mild cognitive impairment,MCI)及AD患者的认知功能,是一种潜在的补偿治疗方法。既往的研究发现,CT能够靶向改善特定认知域的功能,例如单纯记忆训练对MCI患者的记忆提升效果更好。基于小鼠的实验发现,CT能够改善小鼠海马的神经胶质细胞密度,并减少Tau蛋白的沉积。然而,单一认知域的训练效应有限,其迁移效应较弱,功能的改善效应较为单薄,而多域CT则具有更大的迁移效应。基于计算机的自适应认知训练,具有实时监测和自适应的优点,能够根据参与者的表现及时调整训练内容和难度,训练效果更优于传统纸笔CT。然而,既往研究中大部分针对临床诊断AD的患者展开,未能靶向不同类型AD受损的认知功能精准训练。因此,可以结合神经心理学评估和ATN生物标志物,探索CT对不同亚型AD的治疗效果及其潜在的神经机制。
TMS通过感生电流使神经元产生动作电位,能够产生长时程增强效应,具有调节突触效能及脑网络连接性的功能。TMS的干预效应与刺激频率、刺激靶点及刺激模式密切相关。一般认为频率高于1Hz及间歇性θ爆发式的TMS能够增强大脑活动,导致功能结果的变化。尽管已有研究表明,兴奋性的TMS刺激背外侧前额叶、楔前叶及颞顶联合区均能够改善AD的整体认知及记忆功能,但有些结果仍不一致。其主要原因可能是AD存在较大的异质性,不同亚型的AD其神经机制不同,需要不同的刺激靶点。神经影像技术的应用能够探索不同亚型AD的影像机制。磁共振和Tau-PET联合应用的研究发现,不同亚型AD的Tau蛋白在皮层中的分布不同且皮层的萎缩模式也不同,即存在不同的神经机制。通过改进刺激模式,可以增强TMS对认知的促进作用,这种改善效应在AD中同样存在。因此,探索不同亚型AD的刺激靶点、参数优化,是改善TMS治疗AD效果的一个有效途径。现有的研究表明,TMS能够通过改善大脑皮层的可塑性进而改善AD的认知功能,但其对AD病理的影响仍不清楚,今后的研究应当结合生物标记物,探索TMS对AD病理改变的效应。
TES根据其电流的不同又可以分为经颅直流电刺激(tDCS)和经颅交流电刺激(tACS)两种,其中研究较多的是tDCS。tDCS通过调改变神经元静息膜电位从而促进或抑制突触电位的传导,实现大脑功能的调控。阳极的tDCS通过刺激不同脑区,能够改善AD患者的特定认知功能。同时,相比于TMS,tDCS能够同时刺激多个脑区,同时调控同一脑网络中的不同脑区,达到增强效应的目的。Boggio等研究证明了tDCS同时刺激中央执行网络的左侧背外侧前额叶和颞叶皮层能够改善AD患者的视觉记忆功能。但是,一项荟萃分析发现,tDCS对AD患者精神行为症状的改善并不显著。此外,至今尚无研究表明tDCS治疗对AD生物标记物的影响及长期效应如何。因此,未来针对tDCS的应用研究需要着重于改善治疗效果、明确其对AD的长期效应和病理改变的影响。tACS是一种新型的电刺激方法,主要通过外源性的振荡增强效应,同步特异性调控神经元网络的潜力,从而改善大脑功能。研究表明,tACS可以通过直接与持续的皮层振荡活动相互作用来改善健康成年人的特定认知功能。基于小鼠的研究表明,tACS具有减少病理性Aβ和Tau蛋白沉积的效应。然而,目前尚未有tACS应用于AD补偿治疗的报道。因此,未来应当利用生物标志物,探索tACS治疗AD的生物机制。
诸多研究表明,无论是CT、TMS或是TES均能改善AD的临床症状,增加AD及其高危人群的认知储备,有效代偿/延缓AD的发病。因此,补偿治疗的时机可以在出现症状之前,也可以在症状出现之后。而生物标志物的使用,则使得补偿治疗的窗口有效提前,但最佳的干预时机尚不明确。今后应当探索补偿治疗的最佳干预时机,以及在不同AD阶段,最合适的补偿治疗方法。探索不同方法间治疗效应增强的机制、优化不同方法的组合,进一步改善补偿治疗对AD的治疗效应,具有重要意义。
生物标志物框架的提出,对在生物学水平上探索AD有着重要意义,其明确了AD疾病谱系的概念,使AD早期诊断成为可能,为临床表型研究提供了可靠的诊断标准;为AD的干预研究提供了有力的分类依据和观察指标。然而,基于"Aβ假说"而产生的ATN生物框架同样面临着挑战,AD作为多因素、多病理途径参与的复杂脑病综合征,多项单一靶向清除Aβ的药物临床试验不断失败,提示需要及时有效转变思路,从有效预防控制风险因素、共病、生活方式等可控的风险因素开始,到药物治疗和非药物干预多种治疗方法相互结合,为攻克AD带来曙光和希望。
来源:内科急危重症杂志 2021年6月第27卷第3期
JAMA N:长期强化降压(<120mmHg)增加脑灌注,而不
【直播回看】周东教授答疑:癫痫患者在减药停药过程中需要注意什么?
查看更多